Link general
Esta aplicación permite construir mediante la introducción de compuestos químicos o importar desde una base de datos ecuaciones de reacciones químicas
y equilibrarlos. También realiza cálculos estequiométricos con la ecuación balanceada.
Podrás hacer cálculos estequiométricos en la ecuación balanceada. Los resultados se pueden guardar en un archivo de texto. Además, hay una base de datos editable de elementos químicos.
Es un entorno integrado para aspectos que generalmente se tratan por separado:
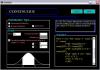
- Equilibrio de reacciones químicas
- Cálculos estequiométricos con compuestos químicos basados en la ecuación balanceada
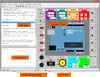
Características de los cálculos estequiométricos Reack:
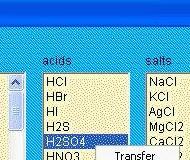
- Las reacciones se pueden guardar e importar desde una base de datos
- Bases de datos editables de compuestos químicos y elementos químicos.
- Balanceo automático o manual de reacciones.
- Cálculos estequiométricos con reacciones equilibradas.
- Los problemas se pueden guardar en un archivo de texto
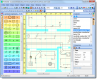
Cálculos estequiométricos Reack:
Los cálculos estequiométricos se basan en las relaciones fijas de combinación que hay entre las sustancias en las reacciones químicas balanceadas. Estas relaciones están indicadas por los subíndices numéricos que aparecen en las fórmulas y por los coeficientes. Este tipo de cálculos es muy importante y se utilizan de manera rutinaria en el análisis químico y durante la producción de las sustancias químicas en la industria. Los cálculos estequiométricos requieren una unidad química que relacione las masas de los reactantes con las masas de los productos. Esta unidad química es el mol.
Ejemplo de la vida diaria. La estequiometria la podemos usar por ejemplo cuando vamos al médico porque tenemos un dolor ocasionado por una infección, el doctor debe de sacar la cuenta de nuestro peso con los gramos que contiene el medicamento y sobre la base de esto sacar la medida exacta para saber cuántas pastillas o cuantos mililitros nos tenemos que tomar de dichos medicamentos.
A los químicos les interesa conocer la masa de reactivos que necesitan para obtener una cantidad de producto determinada en una reacción química, o la cantidad de producto que pueden obtener a partir de una determinada cantidad de reactivos. Los cálculos que hay que hacer para resolver estas cuestiones se llaman cálculos estequiométricos.
Para realizar los cálculos estequiométricos es necesario disponer de la ecuación química ajustada de la reacción. Entonces podemos conocer la cantidad de moléculas de un producto que se puede obtener a partir de una cierta cantidad de moléculas de los reactivos. Por ejemplo con 2 moléculas de hidrógeno (H2) y 1 molécula de oxígeno (O2) se pueden obtener 2 moléculas de agua (H2O). Si sabemos la masa de cada molécula sabemos también la relación entre las masas de reactivos y productos en la reacción. Estas masas si que las conocemos. Se llaman masas moleculares, y se calculan sumando las masas de los átomos que componen las moléculas, las masas atómicas. Estas las encontrarás en cualquier tabla periódica expresada en u (unidades de masa atómica). Pero como puedes imaginar son masas muy pequeñas, del orden de los 10-24 g. Por eso los químicos han definido una nueva unidad para medir el número de partículas (átomos o moléculas), a la que han llamado mol.
A continuación se proponen ejercicios de igualación de ecuaciones químicas, en primer lugar, y de cálculos estequiométricos sencillos, en segundo lugar. Los primeros ejercicios de igualación de ecuaciones químicas pretenden reforzar el concepto de conservación del número de átomos (o de átomos-gramo) de cada elemento en una reacción química. Después se aborda la igualación de reacciones de oxidación reducción, preferentemente por el método del ión-electrón. Los ejercicios de cálculos estequiométricos abarcan la aplicación de razones estequiométricas, la determinación del reactivo limitante, el consumo de reactivos y la formación de productos. La complejidad numérica o de cálculo de los ejercicios no es demasiado grande ya que el objetivo básico es la comprensión de los conceptos.